Anévrisme de l’Aorte Abdominale
L’aorte est une artère principale de l’organisme qui naît à la sortie du coeur, descend dans le thorax et l’abdomen en donnant de nombreuses branches qui vont permettre l’irrigation en oxygène du cerveau et des différents organes (Figure 1). L’anévrisme de l’aorte abdominale (AAA) est une dilatation qui atteint la portion abdominale de l’aorte (Figure 2). L’aorte abdominale mesure en moyenne 18 mm de diamètre chez l’homme, ce diamètre pouvant varier de +/- 4 mm en fonction du sexe et de la corpulence. On parle d’anévrisme de l’aorte lorsque celle ci n’a plus de bords parallèles et se dilate. La dilatation peut être régulière et étendue à la plus grande partie de l’aorte abdominale (anévrisme fusiforme) ou localisée à un segment (anévrisme sacciforme). La dilatation anévrismale de l’aorte est responsable de turbulences du flux sanguin qui vont entraîner la formation progressive de thrombus (caillot ou sang coagulé) sur la paroi interne du sac anévrismal. La croissance de l’AAA est très variable. Le diamètre peut rester stable pendant plusieurs années ou au contraire évoluer rapidement de façon exponentielle. Une surveillance du diamètre de l’anévrisme est donc nécessaire. La croissance est en moyenne de 4 mm par an pour les anévrismes compris entre 40 et 50 mm.
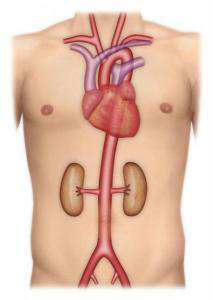
Figure 1 : Anatomie normale de l’aorte
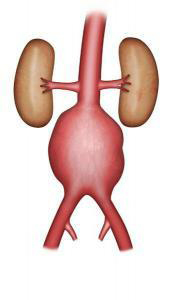
Figure 2 : Anévrisme de l’aorte
D’où vient cette maladie et quelle population atteint-elle ?
C’est une maladie en rapport avec une raréfaction des fibres élastiques dans la paroi de l’artère. Elle atteint le plus souvent les hommes de plus de 60 ans et dans certains cas plus rares les femmes et les sujets plus jeunes. La prévalence (fréquence de la maladie dans la population) est après 60 ans de 4 à 8% chez l’homme et 1 à 3% chez la femme. Cette prévalence est trois fois plus importante en cas de facteurs de risques cardiovasculaires associés (tabac, hypertension artérielle) ou d’antécédents familiaux. L’incidence (nombre de nouveaux cas par an) est de 39 cas/an pour 100 000 habitants. L’athérosclérose (dépôt anormal de plaques graisseuses dans la paroi des artères) est la principale cause d’anévrisme. Dans certains cas plus rares, l’origine de l’anévrisme est infectieuse ou inflammatoire.
Quels sont les risques liés à un anévrisme de l’aorte abdominale ?
Le risque évolutif est la rupture de l’anévrisme qui est souvent mortelle. Ce risque devient important lorsque le diamètre est supérieur à 50 mm. La rupture se fait le plus souvent dans la cavité abdominale, responsable d’une hémorragie massive souvent mortelle. Parfois la rupture est moins importante et permets, après un transfert dans un service de chirurgie vasculaire, d’intervenir en urgence.
Quels sont les symptômes liés à un anévrisme de l’aorte abdominale ?
Le plus souvent, l’AAA n’est responsable d’aucun symptôme. Il est parfois découvert lors d’un examen médical par la palpation abdominale. Il peut être associé à des douleurs abdominales ou lombaires. En cas d’association d’un AAA connu supérieur à 40 mm et de douleurs abdominales ou lombaires, un scanner et un avis en chirurgie vasculaire en urgence sont nécessaires. Lorsque l’anévrisme est petit ou en cas de surcharge pondérale, la détection d’un AAA n’est pas toujours facile. L’AAA est souvent découvert par hasard au cours d’un examen radiologique fait pour une autre pathologie : écho – döppler dans le bilan d’une artériopathie ou d’une maladie veineuse des membres inférieurs, échographie abdominale notamment pour une maladie de la prostate, scanner abdominal ou scanner lombaire pour une pathologie de la colonne vertébrale.
Quels sont les principaux examens pour explorer un anévrisme de l’aorte abdominale ?
L’échographie de l’aorte est un examen simple qui permet de faire le diagnostic d’AAA et de préciser sa taille. Le scanner de l’aorte étudie plus précisément l’anévrisme, ses dimensions et son extension. Lorsque l’anévrisme a été détecté, si sa taille ne justifie pas le traitement, une surveillance semestrielle ou annuelle s’impose par échographie. Le choix et la fréquence de l’examen de surveillance dépendent de la taille de l’anévrisme et de sa morphologie.
Quels sont les principaux traitements ? Quels sont les risques de ces traitements ?
Le traitement d’un AAA nécessite une prise en charge dans un service de chirurgie vasculaire. Afin d’évaluer précisément le risque opératoire, des examens pré – opératoires sont nécessaires : bilan cardiaque, rénal, respiratoire, échographie – döppler des artères carotides. Ces différents examens, ainsi que l’âge du patient, permettent d’évaluer plus précisément le risque du traitement. L’indication du traitement dépend du diamètre mais aussi des critères morphologiques de l’anévrisme et de critères médicaux liés à l’âge et à l’état de santé du patient.
L’indication de traiter un AAA est le plus souvent décidée lorsque le diamètre de l’anévrisme est supérieur à 50 mm. Il faut évaluer le rapport bénéfice/ risque du traitement en comparant le risque de rupture d’une part et le risque opératoire d’autre part. Dans certains cas (anévrisme douloureux, anévrisme ayant une croissance rapide, âge jeune et chez la femme) l’indication peut être discutée avant ce seuil de 50 mm. Chez des patients très âgés ou si les examens pré opératoires révèlent une défaillance d’un ou plusieurs organes, il peut être décidé de poursuivre la surveillance au delà de ce seuil. L’intervention se fait après une consultation d’anesthésie pré – opératoire.
Deux techniques peuvent être proposées pour traiter un AAA
Le traitement chirurgical ou mise à plat greffe, est réalisé depuis plusieurs décennies. Cette intervention nécessite, sous anesthésie générale, une laparotomie (ouverture de l’abdomen). La laparotomie peut se faire par une incision verticale ou transversale de l’abdomen ou par une incision sur le côté gauche. L’abord peut parfois se faire par laparoscopie (par l’intermédiaire de petites incisions et de l’utilisation d’une caméra vidéo). Le chirurgien va remplacer l’aorte par une prothèse vasculaire qui est cousu avec un fils non résorbable à l’aorte saine au dessus de l’anévrisme et à l’aorte ou aux artères iliaques au dessous (Figure 3-4). Cette intervention a une durée variable en fonction de la complexité de l’acte chirurgical. La surveillance post opératoire peut nécessiter un passage de quelques jours en unité de surveillance continue. La durée moyenne de l’hospitalisation est de 8 jours, celle ci pouvant varier en fonction de l’état pré opératoire et des suites post opératoires.
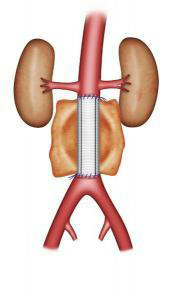
Fig 3 : Pontage aorto-aortique
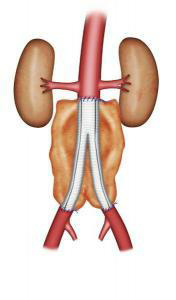
Fig 4 : Pontage aorto bi iliaque
Le traitement endovasculaire consiste à exclure l’anévrisme à l’aide d’une endoprothèse (prothèse vasculaire renforcée d’un stent, ressort métallique). Celle-ci est introduite par les artères fémorales dans l’aine (Figures 5-6). Elle peut être proposée si des critères morphologiques très précis sont respectés. Ces critères anatomiques sont étudié par le scanner .Cette technique ne nécessite pas d’ouverture de l’abdomen. L’abord des artères fémorales se fait soit par une petite incision dans l’aine soit sans ouverture par ponction cutanée. La durée de l’intervention est très variable en fonction de la complexité technique de l’acte. La durée du séjour dépend des suites opératoires. Elle est souvent plus courte que pour le traitement chirurgical.
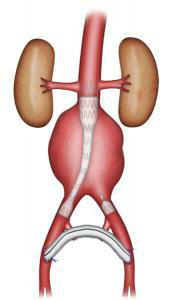
Fig 5 : endoprothèse uni-iliaque
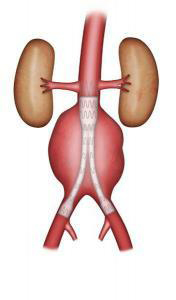
Fig 6 : endoprothèse bifurquée
Comment doit-on être surveillé après avoir été traité ?
Le traitement chirurgical nécessite d’être revu de 1 à 3mois après l’intervention puis régulièrement avec un écho – döppler contrôlant l’absence d’anomalie du pontage et l’absence d’autres localisations de la maladie anévrismale.
Le traitement endovasculaire nécessite un suivi très strict et obligatoire par scanner ou écho – döppler pour vérifier l’exclusion de l’anévrisme et l’absence d’endofuite. Le suivi est semestriel les deux premières années puis annuel ensuite. Certaines endofuites sont des fuites témoignant de la mauvaise étanchéité du traitement. Elles exposent le patient à un risque évolutif de l’AAA et donc au risque de rupture. Elles nécessitent un traitement complémentaire. D’autres endofuites sont à bas débit et ne nécessite pas de traitement complémentaire. En conclusion, il existe plusieurs types d’endofuites qui ne sont pas toutes de la même gravité
Pour en savoir plus…
Etiologie de la maladie :
La raréfaction des fibres élastiques de la paroi aortique aurait plusieurs causes : défaut génétique, perturbation de l’activité des enzymes protéolytiques. Ces anomalies sont favorisées par l’athérosclérose. L’évolution de l’AAA dépend de la loi de Laplace selon laquelle la force appliquée sur la paroi de l’aorte est proportionnelle à la pression artérielle et au rayon (responsable donc d’un cercle vicieux ayant tendance à faire grossir l’anévrisme).
Risque de rupture :
Le taux de rupture annuel est faible lorsque que le diamètre est en dessous de 50mm (inférieur à 1% en dessous de 40mm et entre 0,5 et 3% entre 40 et 49mm). Le taux de rupture annuel est de 3 à 10% lorsque l’AAA est compris entre 50 et 60 mm, de 10 à 20% de 60 à 69 mm et de 20 à 40% pour les AAA supérieur à 70 mm. Les facteurs qui augmentent le risque de rupture sont : une vitesse de croissance supérieure à 10 mm en 1 an, le tabagisme, l’hypertension artérielle, la broncho-pneumopathie obstructive (maladie respiratoire fréquente chez le fumeur), le caractère sacciforme de l’anévrisme. Enfin à diamètre égal, le risque de rupture est trois fois plus élevé chez la femme.
Examens complémentaires :
Le scanner est un examen indispensable dans le bilan pré opératoire d’un anévrisme. Il doit explorer l’ensemble de l’aorte thoracique et abdominale pour dépister un anévrisme associé de l’aorte thoracique. En dessous de 45 mm, un contrôle annuel par écho – döppler est suffisant. Au delà de 45 mm un suivi semestriel est souhaitable.
Risque du traitement :
Les complications post opératoires les plus fréquentes sont, des complications cardiologiques, respiratoires, rénales, hémorragiques, digestives ou infectieuses. Le taux de mortalité post opératoire est en moyenne de 4 à 5 % pour la chirurgie conventionnelle et de 1 à 2 % pour le traitement endovasculaire. Ce bénéfice du traitement endovasculaire sur le taux de mortalité précoce se réduit si l’on étudie la mortalité à distance de l’intervention. Avec le traitement endovasculaire, le risque de ré intervention est plus important.
Traitement :
Dans le traitement endovasculaire, l’exclusion de l’anévrisme peut se faire par une endoprothèse bifurquée qui est constituée de deux branches destinées aux artères iliaques ou par une endoprothèse aorto –uni iliaque qui est alors associée à un pontage croisé entre les artères fémorales droite et gauche. Le choix de la technique endovasculaire est fait en fonction de critères morphologiques définis par l’étude du scanner. Les éléments principaux sont la longueur et le diamètre du collet proximal (segment d’aorte saine avant la dilatation anévrismale), le diamètre des artères iliaques et l’existence de tortuosités iliaques. L’étanchéité de l’endoprothèse est assurée par sa force radiale. Une nouvelle génération d’endoprothèse est en cours d’évaluation (endoprothèse fenêtrée) lorsque le collet proximal est très court. Cette endoprothèse est constituée de fenêtres à son extrémité proximale pour les artères rénales et l’artère mésentérique supérieure (branche de l’aorte qui irrigue l’intestin) afin de permettre un ancrage proximale même en l’absence de collet proximal (Figure 7).
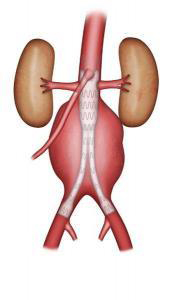
Figure 7 : Endoprothèse fenêtrée
Endofuite :
La présence d’un flux artériel dans le sac de l’anévrisme mais à l’extérieur de l’endoprothèse est une endofuite : les endofuites témoignent d’un manque d’étanchéité de l’endoprothèse. Il existe 4 types d’endofuites : les endofuites de type I sont des fuites proximales ou distales au niveau des zones d’étanchéité de l’endoprothèse. Ce sont les endofuites les plus graves. Elles nécessitent toujours un geste complémentaire. Les endofuites de type II proviennent du reflux des artères collatérales de l’aorte (artères lombaires, artère mésentérique inférieure). Elles sont surveillées et ne nécessitent un traitement qu’en cas d’augmentation du diamètre de l’anévrisme. Les endofuites de type III sont liées à la déchirure de l’endoprothèse ou à une mauvaise étanchéité entre les différents modules de l’endoprothèse. Les endofuites de type IV sont dues à une porosité de la prothèse. Ces deux derniers types de fuites sont très rares et peuvent nécessiter un geste complémentaire (Figure 8).
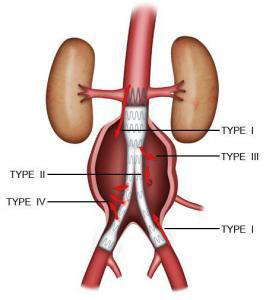
Figure 8 : les différents types d’endofuites



